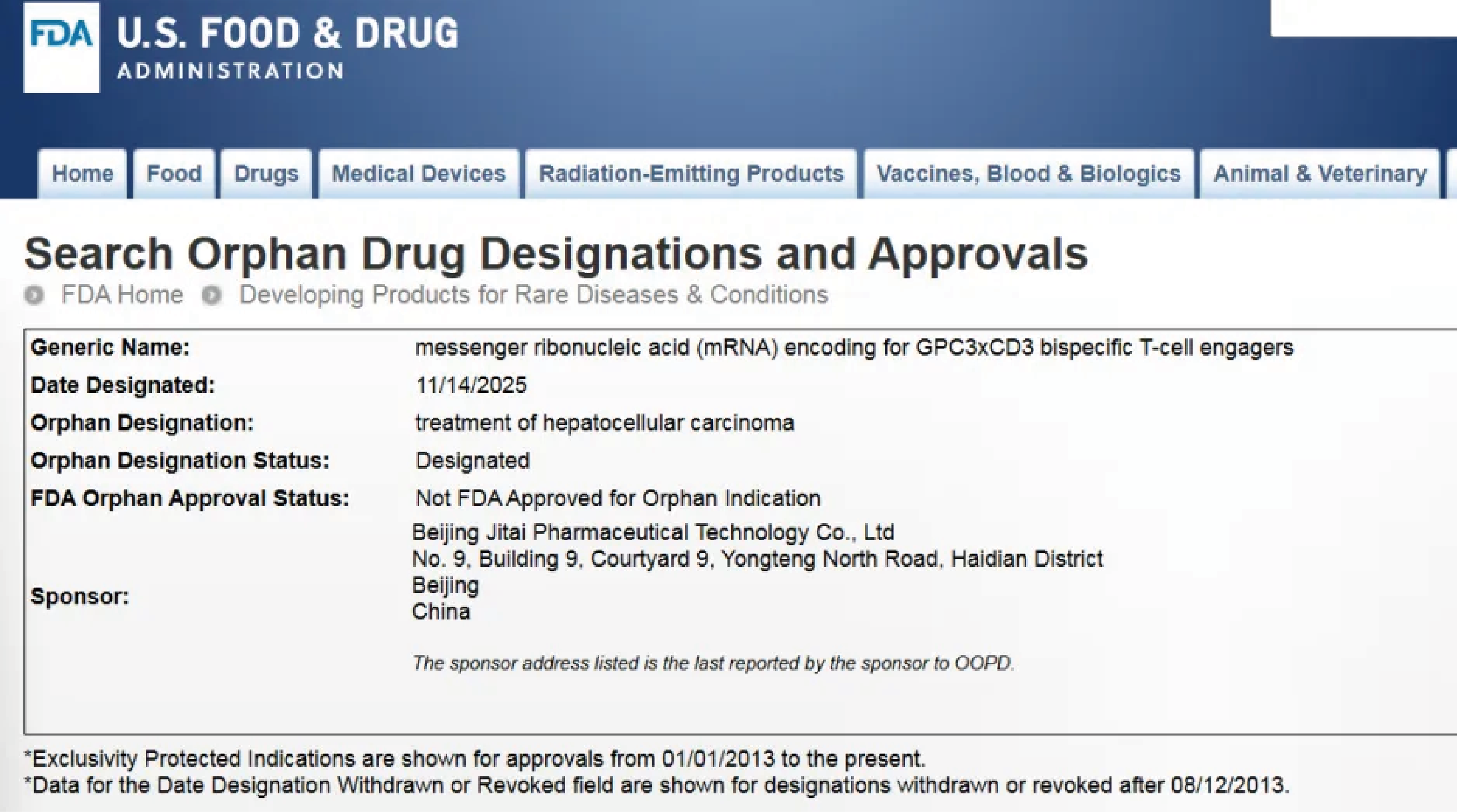
关于孤儿药
FDA孤儿药认定旨在鼓励针对适应症患者人群少于20万的罕见疾病药物研发并相应设立特殊激励政策。获得ODD的候选药物可享受包括临床试验税收抵扣、注册费用减免、快速监管审批通道以及在药品获批后享有最长七年的市场独占期等多项政策激励。
此次认定确认MTS-105具备突破性创新和重要的临床价值。
关于MTS-105
MTS-105是业内首创(FIC)的mRNA编码双特异性抗体(TCE,T细胞衔接器)肝细胞癌治疗候选药物,有望从根本上解决传统基于蛋白的双特异性抗体在实体瘤疗效不理想的难题,成为全球首款mRNA编码TCE实体瘤疗法。目前,MTS-105已进入临床开发阶段。
MTS-105通过剂泰科技自研的肝脏高特异性LNP(纳米脂质颗粒)递送系统完成精准递送,采用“特洛伊木马”策略,mRNA被肝细胞摄取后在体内原位大量编码并分泌双特异性抗体,高效渗透进入肝癌组织后,实现在肿瘤内部诱导T细胞激活并杀伤肿瘤。
研究数据显示,MTS-105在小鼠、大鼠和食蟹猴模型中,肝脏药物暴露量显著高于血浆,组织特异性药物富集显著优于抗体性TCE;在食蟹猴实验中,所有受试动物在测试剂量下均耐受良好,未出现严重不良反应,其独特的缓释特性可支持每周一次给药;小鼠模型数据显示,组织内暴露量显著增加,在低至0.15μg剂量下试验小鼠实现100%完全缓解,肿瘤完全清除,而对照组的抗体性TCE在1 mg/kg(约20微克)剂量下仅表现出约50%的肿瘤生长抑制;MTS-105治愈(无瘤)小鼠在再次接种新肿瘤后仍保持无瘤状态,显示出长期免疫记忆效应。
MTS-105是剂泰科技“火箭+卫星”核酸药研发创新范式的标杆管线,其开发基于剂泰科技自研的AI纳米递送平台NanoForge,分别依托NanoForge驱动的AiLNP与AiRNA双平台,显著加速了LNP和mRNA的设计周期,并大幅提升了靶向肝脏的递送效率与安全性。
关于肝细胞癌
肝细胞癌是全球第三大癌症死因,年新发病例超80万例,中国新发病例占比超50%。临床现有疗法局限显著,晚期一线靶向药客观缓解率仅2%-3%,生存期改善有限;免疫单药或联合方案响应率不足20%,且患者容易出现耐药。肝癌患者迫切需要更高效、低毒的创新疗法。
关于剂泰科技
AI纳米递送,开启健康未来。剂泰科技是一家人工智能(AI)驱动纳米材料创新的生物科技公司,专注于利用靶向药物递送和发现技术,帮助生命体战胜疾病和衰老,重获健康和活力。